
编者按
FH缺陷型肾细胞癌(FH-deficient RCC),是一种罕见且侵袭性强的肾癌亚型,与延胡索酸水合酶(FH)基因突变相关。它好发于年轻人群,确诊时常常已发生转移,且对现有靶向药和免疫疗法反应不佳,预后极差。CHD6作为染色质域解旋酶DNA结合蛋白家族的一员,目前,对CHD6在染色质重塑和FH缺陷型肾细胞癌中的关键作用研究还知之甚少。
本期我们分享2025年2月17日,由中国科学技术大学张传杰教授课题组、浙江中医药大学金娟/何强教授团队等共同发表在肿瘤学老牌权威杂志Cancer Research(IF=12.5)上的最新研究成果,该研究利用斑马鱼PDX、类器官、小鼠等多模型及基因编辑技术,首次揭示了CHD6在FH缺陷型RCC中的关键作用,并阐明FH缺陷通过延胡索酸-KEAP1-CHD6轴稳定CHD6蛋白,进而驱动促炎增强子组装和NF-κB激活,也首次发现CHD6是FH缺陷RCC的合成致死靶点,提出了利用PROTAC降解剂靶向CHD6复合物SMARCA2/4治疗FH缺陷RCC的新策略,为理解FH缺陷RCC的发病机制提供了新视角。
本研究中,环特生物提供的斑马鱼PDX、肿瘤类器官等实验服务支持,进一步验证了CHD6敲除或AU-15330处理可显著抑制FH缺陷型肿瘤生长与转移,揭示了CHD6在FH缺陷型肾癌中的核心作用。
01、研究亮点
首次揭示CHD6在FH缺陷型RCC中的关键作用,并阐明其通过KEAP1-CHD6-NF-κB轴驱动肿瘤恶性进展;
利用斑马鱼PDX、肿瘤类器官、小鼠等多模型及基因编辑技术,发现并验证了CHD6是FH缺陷型RCC的合成致死靶点,具有高度特异性;
提出“代谢-表观遗传-炎症”三位一体的致病机制,将FH缺失与NF-κB驱动的炎症增强子联系起来;
证实AU-15330作为潜在治疗药物,展现出对FH缺陷型RCC的显著疗效。
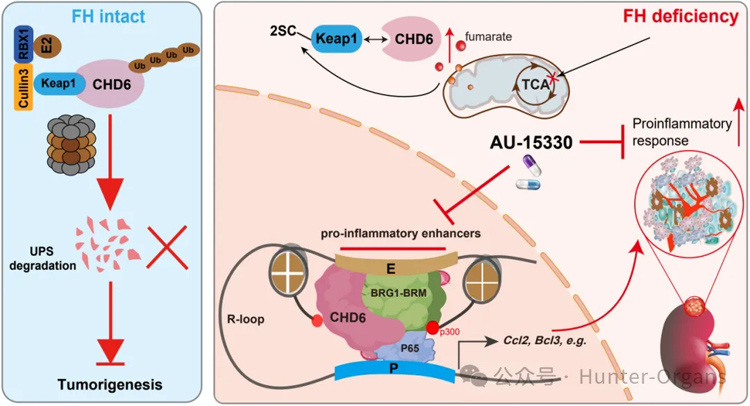
图形摘要
02、主要研究成果
1. 通过基因编辑技术筛选,确定CHD6是FH缺陷型肾细胞癌的关键表观遗传调控因子
为了识别FH缺陷型肾细胞癌(RCC)中细胞内的表观遗传学调控因子,研究人员进行了基因编辑筛选实验,并构建了524个靶向表观遗传学调控因子、41个重要生长基因及162个无靶向对照序列的质控SgRNA库。随后,还构建了FH缺陷UOK262及野生ACHN肾癌细胞株。通过负向dropout筛选算法及验证,鉴定了31个潜在的候选靶点,通过进一步小规模的筛选后发现,CHD6是最有效的候选物。敲减CHD6可显著遏制FH缺陷肾癌细胞株的恶性增殖及转移能力,而对FH野生肾癌细胞株并无显著影响。
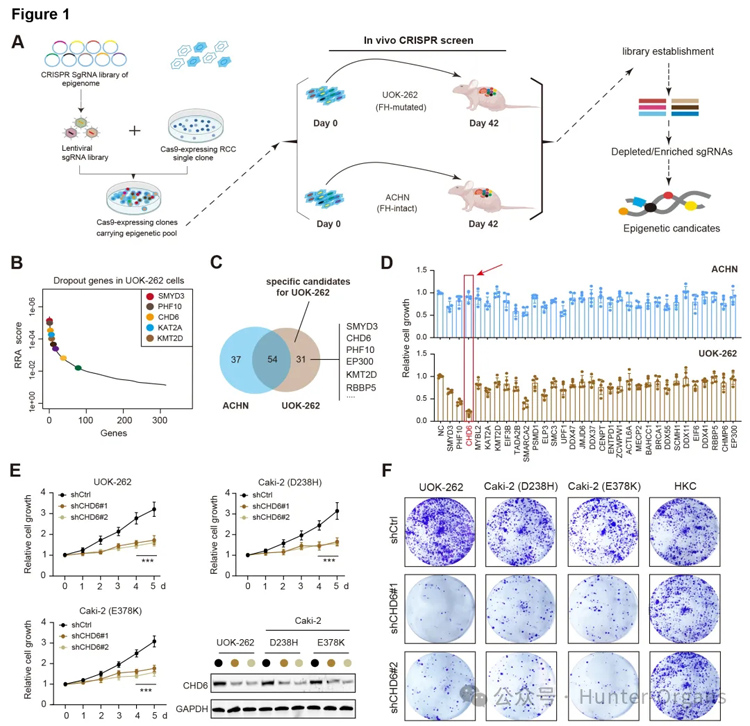
图1
2. CHD6受KEAP1调控,通过泛素-蛋白酶体途径降解,FH缺陷导致CHD6蛋白稳定
随后,研究人员发现FH缺陷细胞中的CHD6蛋白质水平显著高于FH野生型细胞,而CHD6的mRNA水平则大致相当。CHD6的稳定性可能在FH缺陷细胞中受到泛素-蛋白酶体途径的调控。ACHN细胞中,CHD6和Keapl之间存在内源性相互作用,但CHD6与肾癌另一重要的连接酶蛋白pVHL之间未检测到相互作用。体外泛素化分析显示,FH缺陷细胞中CHD6的泛素化水平降低。在FH野生肾癌株中,Keap1可介导CHD6发生多聚泛素化修饰的蛋白降解。因此,CHD6受KEAP1调控,在FH肾细胞癌(RCC)中通过泛素-蛋白酶体途径降解。
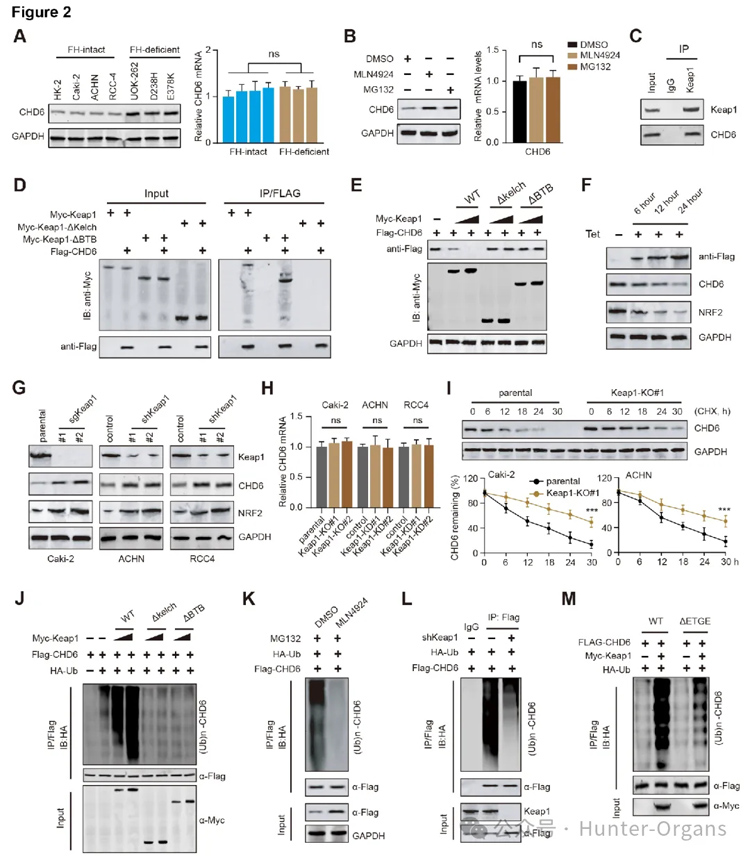
图2
进一步探究发现,Keap1失活或癌源性突变体在FH缺陷型RCC中无法有效降解CHD6蛋白。FH敲低导致ACHN细胞中泛素化的Keap1增加,进而使Keap1蛋白水平下降。延胡索酸积累导致KEAP1发生琥珀酰化修饰,使其失去结合并泛素化标记CHD6的能力。在FH突变肾癌中,Keap1琥珀酰化失活可导致一系列下游底物的蛋白累积,如NRF2、IKKβ等。CHD6无法被有效泛素化标记,从而逃逸了蛋白酶体介导的降解途径,导致其蛋白水平升高。因此,FH缺陷通过延胡索酸介导的KEAP1失活,稳定了CHD6蛋白。
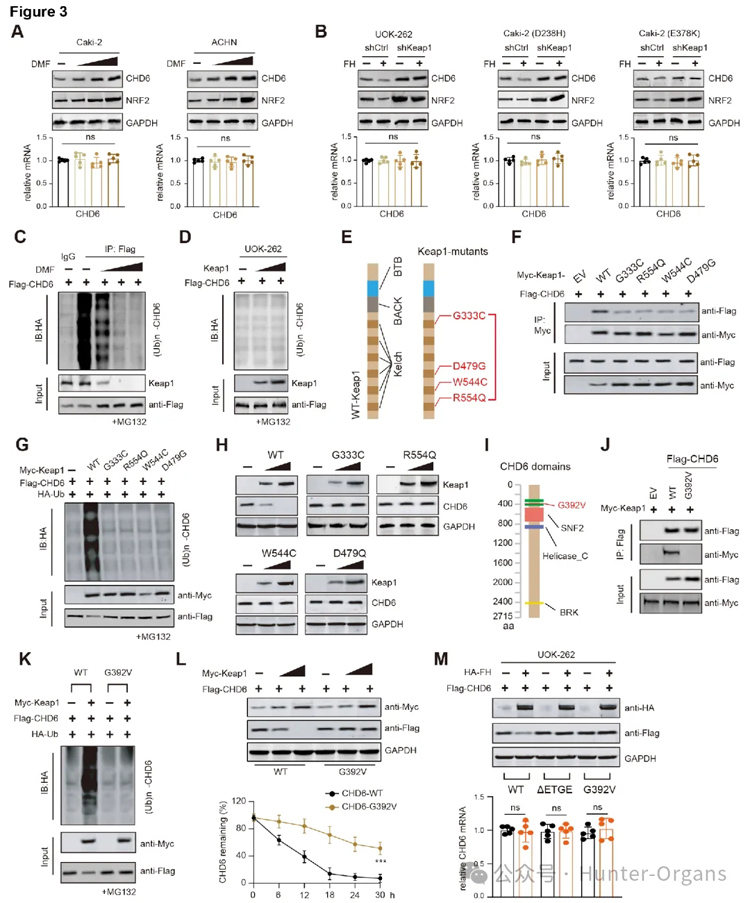
图3
3. 斑马鱼PDX、肿瘤类器官、小鼠模型等均证实,CHD6是FH缺陷RCC的合成致死靶点
接着,研究人员通过大规模的基因编辑筛选,发现CHD6是FH缺陷RCC细胞生长所必需的基因,CHD6失活与FH缺陷之间存在合成致死效应。FH/CHD6双敲除抑制Caki-2细胞的体内生长和肺部转移。通过肿瘤生长曲线和IHC分析显示,在FH缺陷的UOK262和ACHN细胞中,使用基因编辑技术敲除CHD6,导致细胞增殖能力显著下降,克隆形成能力减弱。小鼠模型实验结果表明,敲除CHD6显著抑制了FH缺陷RCC的生长。
为了同时观察肿瘤生长与转移情况,研究人员进一步构建了斑马鱼PDX(肿瘤异种移植)模型,发现FH缺陷增强了肿瘤细胞在斑马鱼体内的扩散和向尾部区域的转移。斑马鱼PDX实验显示,与FH正常组相比,CHD6的敲除显著抑制了FH敲低所诱导的转移表型,但并未显著影响源自FH正常的Caki-2细胞的卵黄囊内原发性移植瘤的生长能力。与对照组相比,FH/CHD6双敲除组的原位移植瘤表现出显著的生长抑制,这从肿瘤大小及IHC标记物中得以证实。
随后,进一步构建了患者来源的的肿瘤类器官(PDOs)与患者来源的异种移植瘤模型,实验结果显示,与之前的结果一致,CHD6敲低显著抑制了FM-RCC类器官的生长,但不影响FH野生型类器官。总之,实验结果表明,CHD6对于FH缺陷RCC的生存和生长至关重要,是一个潜在的合成致死靶点。
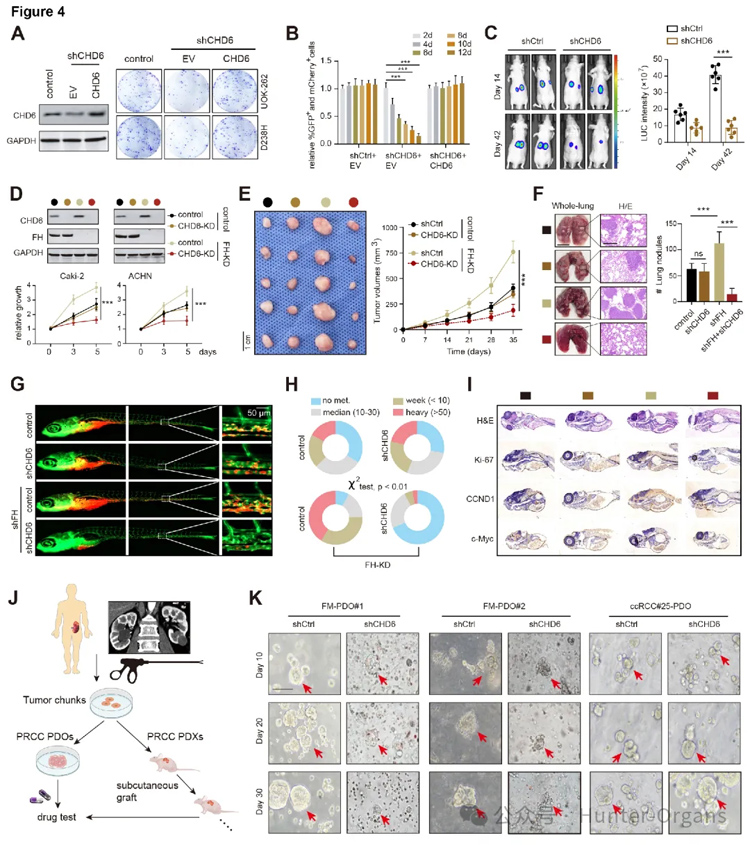
图4
4. CHD6驱动促炎增强子的建立,并维持染色质开放性
随后,研究人员发现稳定的CHD6蛋白在细胞核内发挥着关键作用,CHD6主要调控FH缺陷肾细胞癌中的NF-κB炎性通路,并与p65存在内源性互作。在FH野生肾癌株中,逐步剂量DMF处理细胞,可显著促进CHD6-p65的两者结合,及提升下游炎性靶点的表达。CHD6-p65复合物能够结合到基因组上的特定区域,这些区域具有典型的增强子特征。高通量测序显示,CHD6和p65在NF-κB靶基因增强子处有显著共结合峰,且在DMF刺激后尤为明显。在FH缺陷细胞中,CHD6和p65的结合位点富集于已知的促炎基因,如CCL2、ICAM1、BCL3的启动子/增强子区域。使用dCas9-KRAB系统沉默这些CHD6结合的增强子,观察到相应促炎基因的表达显著下降。因此,CHD6通过与p65合作,直接参与建立和维持促炎基因的增强子活性,从而驱动炎症反应。
多轮IP-re-IP实验筛选,发现CHD6通过招募SMARCA2/4,提升增强子结合处的染色质开放可及性,进而激活和维持下游炎性靶点的表达。靶向CHD6-SMARCA2/4复合物,可有效破坏染色质开放构象,阻断增强子复合物形成,进而遏制下游转录调控。这种由CHD6介导的染色质开放性,是维持其下游促炎基因表达所必需的。ATAC-seq分析显示,CHD6结合的增强子区域在FH缺陷细胞中呈现出更高的染色质开放度,其中,Tn5插入信号更强。因此,CHD6通过招募mSWI/SNF复合物,确保了其调控的促炎增强子区域的染色质处于开放状态,从而促进基因表达。
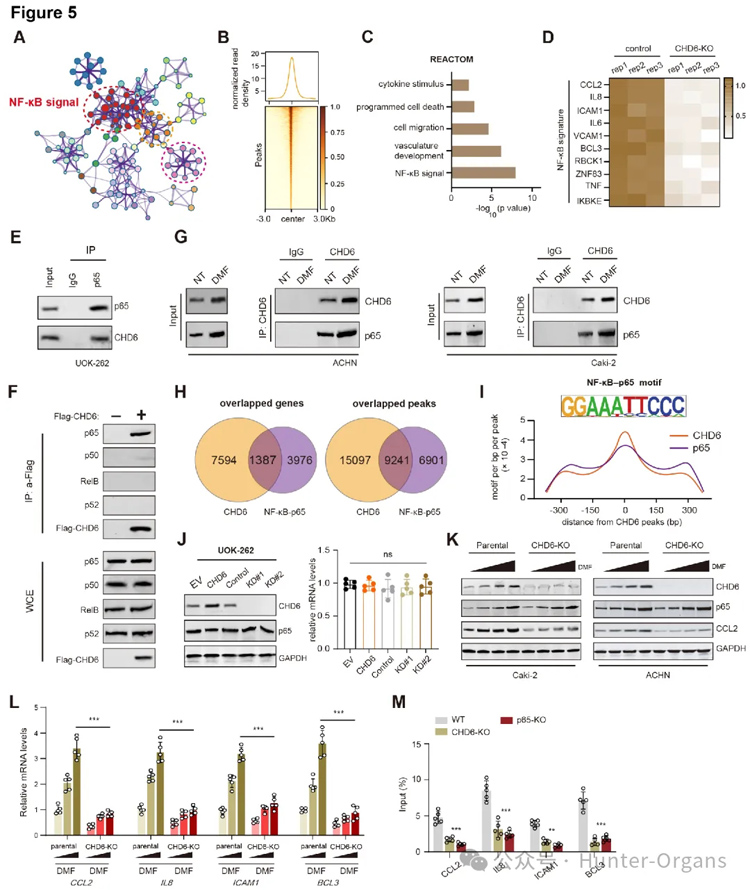
图5
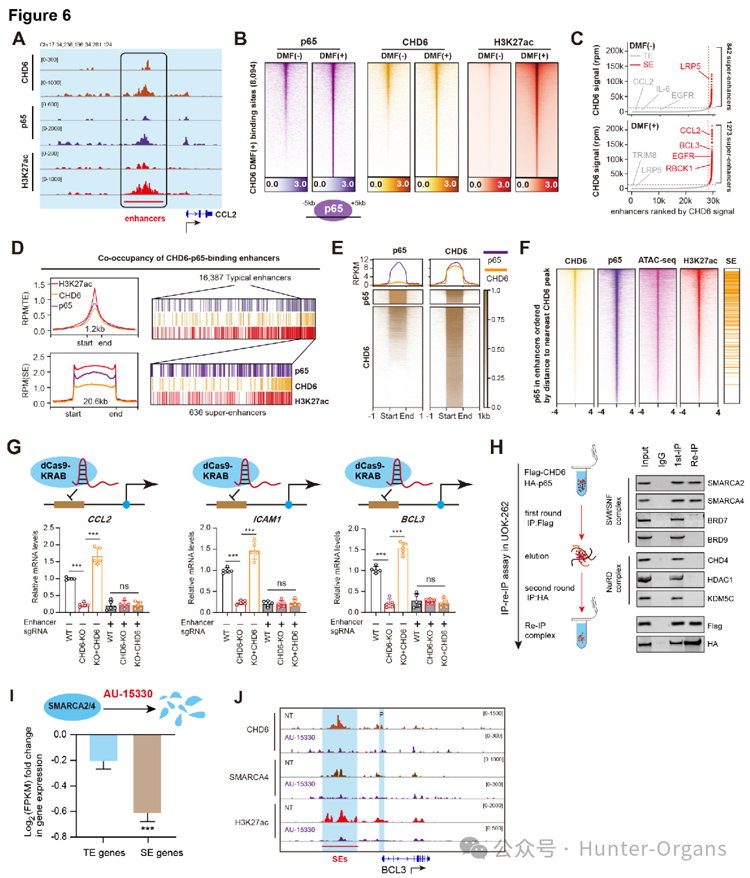
图6
5. 靶向CHD6依赖的SWI/SNFATP酶,可有效抑制FH缺陷型肾细胞癌
由于CHD6是合成致死靶点,且其功能依赖于与p65和mSWI/SNF复合物(含SMARCA2/4)的相互作用,那么,破坏这些相互作用或降解这些复合物成员可能是一种有效的治疗策略。因此,研究人员利用PROTAC(蛋白降解靶向嵌合体)分子AU-15330,来降解SMARCA2/4蛋白。
细胞和类器官实验结果显示,AU-15330能高效抑制FH缺陷的肿瘤细胞,而对正常细胞影响很小;在小鼠模型中,AU-15330显著抑制了FH缺陷肿瘤的生长和转移,其效果甚至优于现有标准靶向药舒尼替尼;在斑马鱼PDX中,AU-15330对来自真实患者的FH突变肿瘤同样有效,证明了其巨大的临床转化潜力。总之,靶向CHD6依赖的SWI/SNFATP酶,可有效抑制FH缺陷型肾细胞癌,是一种针对FH缺陷RCC的有前景的治疗策略。
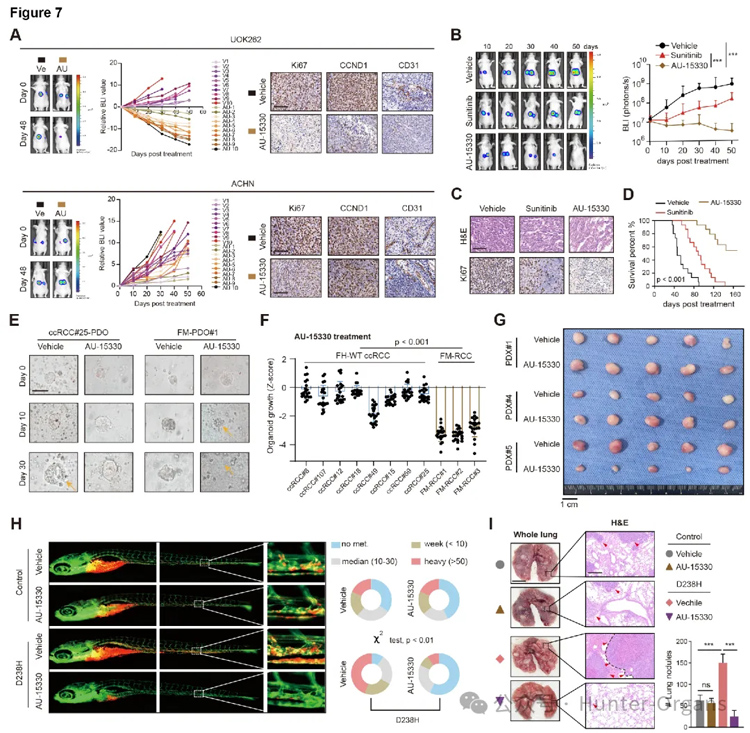
图7
为本研究中,环特生物提供了斑马鱼PDX、肿瘤类器官等实验服务支持,多维度验证了CHD6在FH缺陷型肾癌中的核心作用。为了更好地助力科学研究,环特生物依托国际领先的斑马鱼、类器官、哺乳动物、人体临床等多维生物技术服务平台,“科研预存大礼包”活动进行中,致力于成为您科研路上最值得信赖的伙伴!欢迎新老客户咨询!
03、编者点评
本研究通过斑马鱼PDX、肿瘤类器官、小鼠等多模型揭示了CHD6在FH缺陷型肾癌中的核心作用,还提出了靶向CHD6/SMARCA2/4增强子通路作为该罕见肿瘤亚型的潜在治疗策略,为临床转化提供了新的理论基础和实验依据。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、基因编辑、类器官、哺乳动物、人体”等多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,脑类器官、胃癌、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!
参考文献:
Jin J, Luo J, Jin X, et al. Chromatin Helicase CHD6 Establishes Pro-inflammatory Enhancers and is a Synthetic Lethal Target in FH-Deficient Renal Cell Carcinoma. Cancer Res. 2024. doi:10.1158/0008-5472.CAN-24-0787.
