免疫检查点阻断(ICB)治疗是一种有效的治疗策略,但在转移性结直肠癌(mCRC)患者中,只有少数患者对ICB治疗有应答。近期有研究表明肠道微生物群可能影响肿瘤对免疫治疗的应答,并且与ICB的免疫相关毒性有关。粪菌移植(FMT)已被证明可以克服黑色素瘤患者对免疫疗法的耐药性。
具核梭杆菌(F. nucleatum)是一种致病性肠道细菌,与CRC预后不良相关。它产生的毒力因子如Fap2和FadA在肿瘤中发挥作用,并促进CRC的生长。此外,具核梭杆菌产生的代谢物如琥珀酸、甲酸和丙酸在介导微生物群和宿主免疫系统之间的相互作用中起到关键作用。特别是甲酸盐被报道可加剧CRC细胞的干性、侵袭和转移。然而,目前还没有阐明具核梭杆菌代谢产物与免疫治疗之间的相互作用及其在结直肠癌中的潜在机制。

2023年5月,上海交通大学医学院附属仁济医院消化内科房静远/陈萦晅团队在Cell Host & Microbe(IF 30.3)发表了题为“Fusobacterium nucleatum-derived succinic acid induces tumor resistance to immunotherapy in colorectal cancer”的文章。本研究整合了接受免疫治疗的CRC患者的代谢组学和微生物组数据,发现在接受免疫治疗的CRC患者中,具核梭杆菌的存在与免疫治疗无应答有关。具核梭杆菌通过产生琥珀酸降低对抗PD-1单克隆抗体的敏感性,并抑制了肿瘤微环境中CD8+T细胞的转运,从而限制了抗肿瘤反应。这些研究揭示了具核梭杆菌代谢产物与免疫治疗之间的相互作用,为克服免疫治疗耐药性提供了潜在策略。(麦特绘谱提供Q300全定量代谢组检测服务)
高丰度的具核梭杆菌与mCRC免疫治疗疗效下降相关
研究人员对接受PD-1阻断剂联合瑞戈非尼(regorafenib)治疗的9例(队列1A)mCRC患者进行了宏基因组测序,并分析了粪便中的细菌模式,发现在这些患者中,应答者和无应答者之间的粪便样本的β多样性存在显著差异,而α多样性没有显著差异。此外,通过线性判别分析(LEfSe)分析,研究人员发现在无应答者的粪便中富集了梭杆菌属(Fusobacterium)、拟杆菌属(Alistipes)、Odoribacter、Bilophila和Indibacter等细菌。实时荧光定量PCR结果显示,在无应答者组的粪便样本中,具核梭杆菌是含量最高的细菌。在队列1B中,具核梭杆菌丰度较高的患者的无进展生存期(PFS)低于具核梭杆菌丰度较低的患者。放射学图像显示,在队列1A中,患者2的粪便具核梭杆菌丰度相对较低。在接受PD-1阻断治疗后,肿瘤消退并且核瘤丰度下降,而具核梭杆菌丰度较高的患者9显示肿瘤进展。接下来,队列2中检测了接受PD-1阻断剂联合瑞戈非尼治疗的mCRC患者的福尔马林固定石蜡包埋(FFPE)肿瘤组织中具核梭杆菌的丰度。实时荧光定量PCR显示,与有反应的患者相比,无反应的患者的FFPE组织中具核梭杆菌升高,而其他细菌没有升高。且与具核梭杆菌丰度较低的患者相比,具核梭杆菌丰度较高的患者的PFS和总生存期(OS)较差。此外,研究人员利用队列2中结直肠癌患者的粪便微生物移植(FMT),对使用抗生素混合物(ABX)进行处理的小鼠进行重新定植,结果显示,接受低具核梭杆菌应答者粪便样本的小鼠对PD-1抗体敏感,而接受高具核梭杆菌应答者粪便样本的小鼠对PD-1抗体产生耐药性。这些研究结果表明高具核梭杆菌丰度与mCRC患者免疫治疗效果下降相关。

图1. 高丰度的具核梭菌与mCRC免疫治疗疗效下降相关
具核梭杆菌损害抗肿瘤CD8+T细胞免疫以降低对免疫治疗的反应
为探讨具核梭杆菌对抗PD-1单抗体内抗肿瘤效应的影响,作者将MC38和CT26肿瘤细胞分别接种于无菌(GF)和SPF小鼠皮下。在小鼠出现可触及的肿瘤时,对其进行抗PD-1单抗治疗和具核梭杆菌口服给药,研究发现抗PD-1抗体可以减缓肿瘤生长。但是在用两种具核梭杆菌菌株(ATCC-25586或ATCC-23726)灌胃的小鼠中,其疗效逐渐减弱。16S rRNA测序进一步表明,具核梭杆菌在免疫治疗期间未影响总体肠道微生物群组成。由于具核梭杆菌菌株(ATCC-25586)是标准毒力菌株,并且在之前的研究中被广泛使用,因此研究者选择它进行进一步的机制研究,进一步证实了具核梭杆菌在降低GF小鼠抗PD-1单抗疗效中起着直接作用。此外,具核梭杆菌降低了SPF CT26荷瘤小鼠对抗PD-1单抗的敏感性。
为了研究具核梭杆菌是否损害了抗PD-1单抗的免疫应答,作者检测了MC38荷瘤小鼠肿瘤、脾脏和引流淋巴结(DLN)的不同免疫细胞亚群。免疫细胞图谱显示,在抗PD-1单抗存在的情况下,口服具核梭杆菌减少了肿瘤内CD8+T细胞的浸润,但未减少脾脏或DLN组织内的浸润,而肿瘤内的CD4+T细胞、自然杀伤细胞或调节性T细胞无差异。与此同时,通过免疫组织化学染色(IHC)观察到,在使用抗PD-1单抗的具核梭杆菌肿瘤中,CD8+T细胞较少。这些数据表明,具核梭杆菌可能通过抑制CD8+T细胞的聚集和细胞毒性来降低免疫治疗的疗效。

图2. 具核梭杆菌损害抗肿瘤CD8+T细胞免疫以降低对免疫治疗的反应
具核梭杆菌通过其代谢物琥珀酸减弱对免疫治疗的反应
作者对队列1A的血清样本进行了代谢组学分析,研究发现4种代谢物在无应答者中显著升高(图3A),同时,采用非靶向液相色谱-串联质谱(LC-MS/MS)鉴定了培养上清液中具核梭杆菌显著升高的代谢物(图3B)。然后,进一步分析了日本一个队列(Yachida队列)中梭杆菌水平高的CRC患者的代谢组学数据。维恩图中三个数据集的重叠表明,琥珀酸可能是具核梭杆菌的代谢物,影响CRC的免疫治疗反应(图3C)。
随后,作者检测了细菌培养上清液中的琥珀酸水平,发现两种具核梭杆菌菌株产生的琥珀酸水平是大肠杆菌或BHC(脑心浸液培养基)培养的2~5倍以上。之前有报道显示,在厌氧环境下,具核梭杆菌主要通过三羧酸循环(TCA)的还原分支途径(草酸/苹果酸/延胡索酸/琥珀酸)产生琥珀酸,其中最后一步由延胡索酸还原酶(frd)催化。为了进一步验证具核梭杆菌产生琥珀酸的能力,研究人员在具核梭杆菌中敲除了frdA。与野生型具核梭杆菌相比,具核梭杆菌缺乏frdA导致琥珀酸产量减少(图3F)。然后测定了GF小鼠的琥珀酸浓度,发现在经抗PD-1单抗治疗的具核梭杆菌单定植小鼠中,粪便和血清琥珀酸均升高。接下来,使用两种结直肠癌的皮下小鼠模型来检测琥珀酸是否对体内抗PD-1单抗反应有直接影响。与PBS相比,琥珀酸口服给药和腹腔内给药均降低了体内免疫疗法的治疗效果。此外,口服或腹腔内给予琥珀酸联合抗PD-1单抗治疗显著减少了CD8+T细胞在肿瘤中的浸润,并损害了CD8+T细胞的细胞毒性。
为了确定琥珀酸的临床相关性,研究者分析了Yachida队列中的粪便琥珀酸水平,发现CRC患者的粪便琥珀酸水平高于健康受试者的粪便琥珀酸水平。与此一致,队列4的CRC患者的血清琥珀酸水平也比健康受试者高。在队列4配对的CRC患者中,观察到血清琥珀酸水平与粪便具核梭杆菌丰度呈正相关。为了研究琥珀酸与CRC免疫治疗之间的关系,收集了队列5中接受抗PD-1单抗治疗的33例mCRC患者的血清样本,发现对免疫治疗无应答的患者有显著较高的琥珀酸水平,并且血清琥珀酸水平较高的患者与血清琥珀酸水平较低的患者相比,PFS较短。由于之前的文章已经报道拟杆菌门被认为是琥珀酸的主要产生者,因此研究者在MC38携带肿瘤的SPF小鼠中研究了粪便脆弱拟杆菌(B. fragilis)、普通类杆菌(B. vulgatus)和多形拟杆菌(Bacteroidetes thetaiotaomicron)的丰度,发现具核梭杆菌给药后,脆弱拟杆菌、普通拟杆菌和多形拟杆菌的丰度无差异。综上所述,具核梭杆菌通过其代谢产物琥珀酸减弱对免疫治疗的反应。
琥珀酸受体1(SUCNR1)是一种琥珀酸受体。因此,接下来研究具核梭杆菌是否通过SUCNR1降低了对肿瘤细胞的免疫治疗效果。在MC38肿瘤荷瘤小鼠中,敲低SUCNR1可阻断具核梭杆菌诱导的免疫治疗耐药性。这些数据表明,由具核梭杆菌代谢产物琥珀酸介导的免疫治疗失败反应依赖于结直肠癌细胞上的SUCNR1受体。
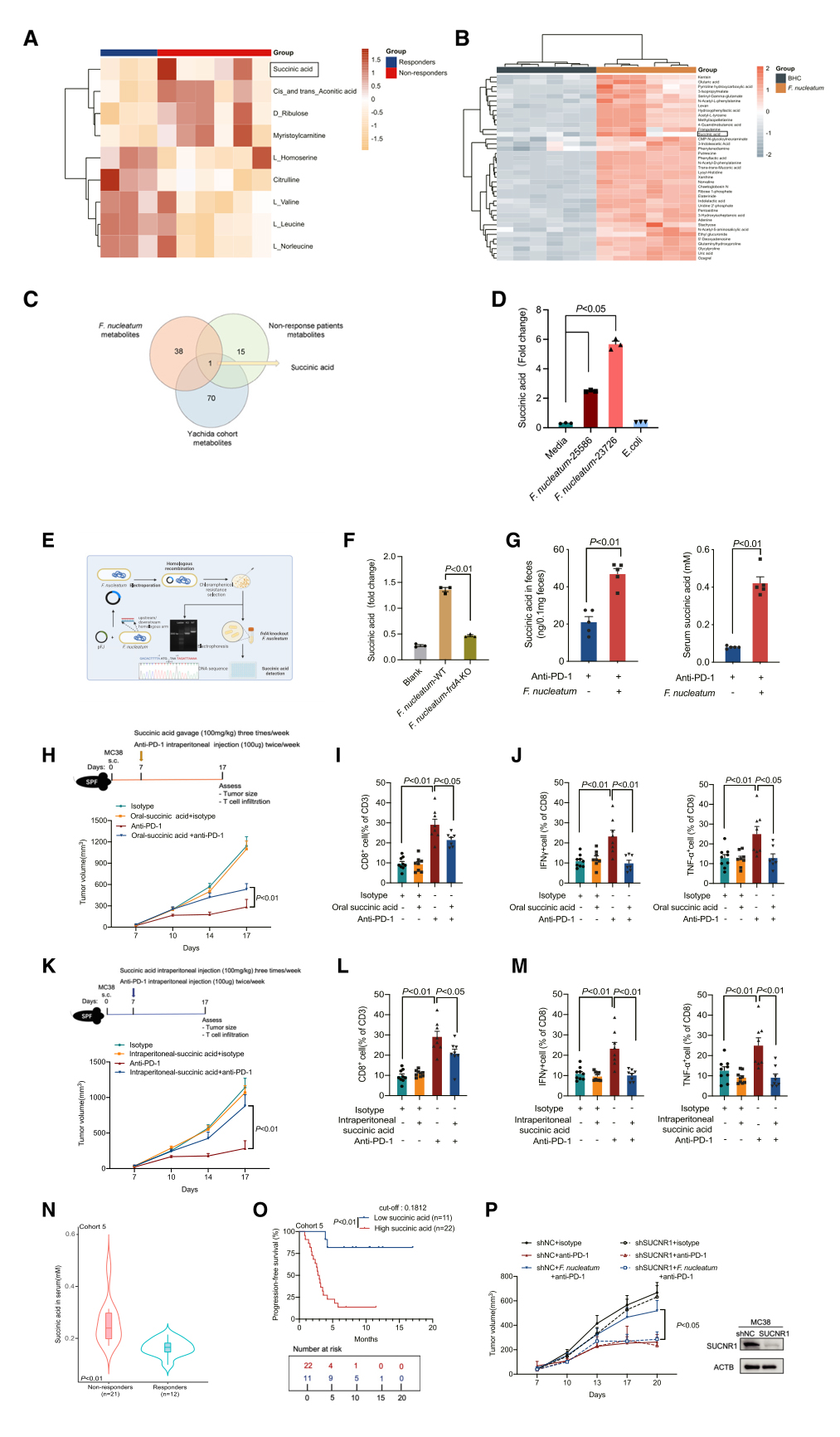
图3. 具核梭杆菌通过其代谢物琥珀酸减弱对免疫治疗的反应
用甲硝唑清除肠道具核梭杆菌可使肿瘤对免疫治疗重新敏感
为了确定用抗生素清除肠道具核梭杆菌是否会使肿瘤对免疫治疗重新敏感,作者使用甲硝唑(梭杆菌敏感)和红霉素(梭杆菌耐药)对小鼠进行了治疗。观察到甲硝唑使具核梭杆菌诱导的耐药肿瘤对抗PD-1单抗重新敏感(图4A),并降低了粪便具核梭杆菌丰度和血清琥珀酸水平。然而,口服红霉素并未使肿瘤对抗PD-1单抗重新敏感,并影响粪便具核梭杆菌丰度和血清琥珀酸水平。在CT26荷瘤小鼠中也观察到类似结果。此外,在接受具核梭杆菌和抗PD-1单抗治疗的小鼠中,甲硝唑足以恢复肿瘤内CD8+T细胞浸润和细胞毒性。为了确定甲硝唑清除具核梭杆菌是否通过激活CD8+T细胞介导的抗肿瘤免疫使肿瘤对抗PD-1单抗重新敏感,研究者使用CD8-或CD4-中和抗体去除小鼠的CD8+或CD4+T细胞。发现在用甲硝唑根除具核梭杆菌后,清除CD8+T细胞(而不是CD4+T细胞)消除了抗PD-1单抗的疗效。这些数据表明,用抗生素甲硝唑根除具核梭杆菌可通过CD8+T细胞依赖的方式使肿瘤对抗PD-1单抗重获敏感。
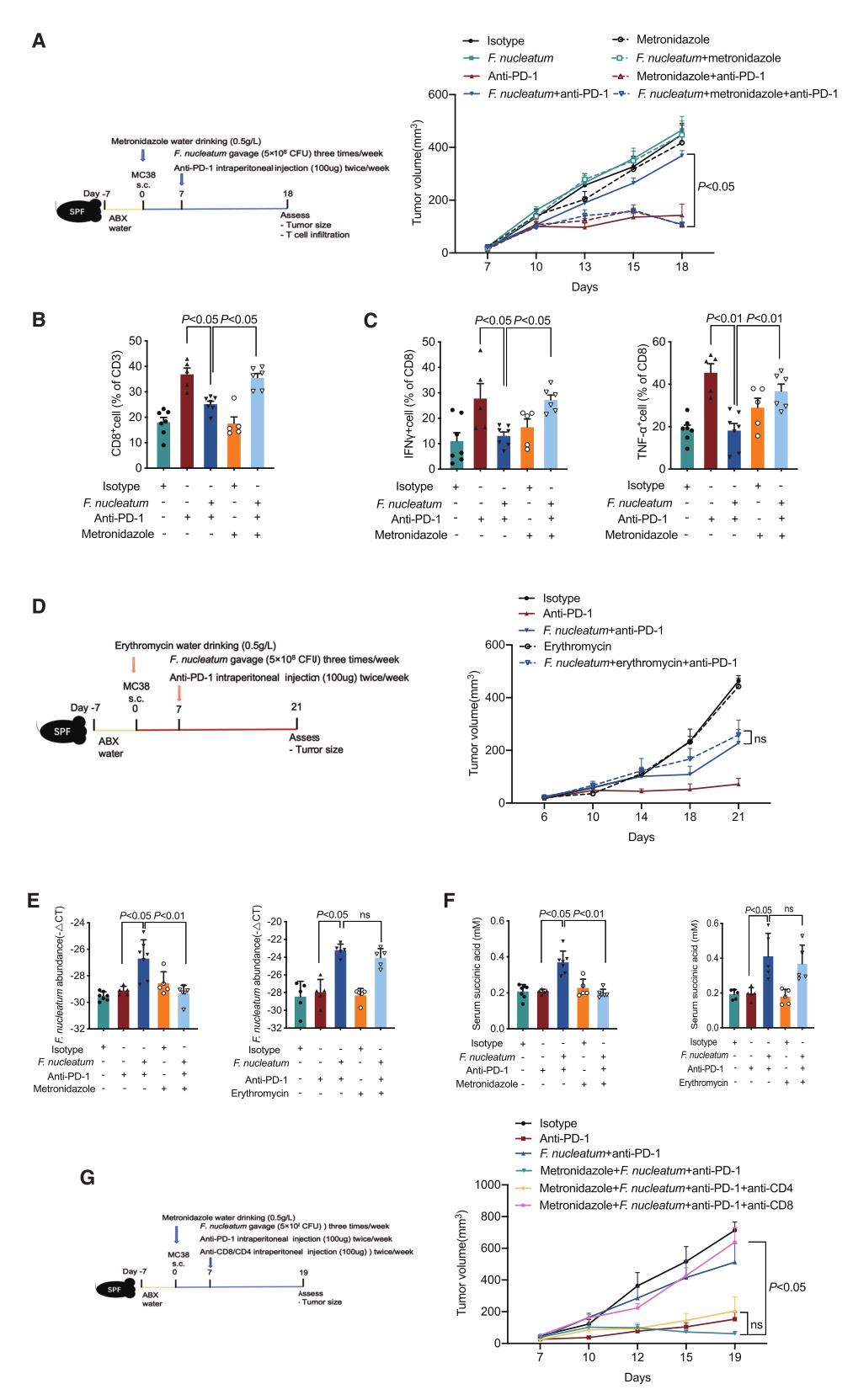
图4. 甲硝唑消除肠道核仁梭菌使肿瘤对免疫治疗重新敏感
具核梭杆菌衍生的琥珀酸损害cGAS介导的IFN-β反应,从而减弱对免疫治疗的反应
为了研究具核梭杆菌衍生的琥珀酸损害抗肿瘤免疫的分子机制,作者在抗PD-1和具核梭杆菌联合抗PD-1单抗治疗的GF小鼠之间的肿瘤中进行了RNA-seq分析。研究发现,在具核梭杆菌联合抗PD-1单抗治疗的小鼠肿瘤中,与“IFN-β产生”和“适应性免疫应答”相关的基因显著减少(图5A)。有文献报道,免疫应答缺失与癌症的免疫逃避和免疫治疗抵抗有关。实时荧光定量PCR显示,在抗PD -1单抗存在的情况下,具核梭杆菌降低了MC38和CT26荷瘤小鼠肿瘤中的IFN-β水平。为了进一步阐明具核梭杆菌代谢产物琥珀酸对IFN-β的作用,研究者在人结直肠癌细胞系(HT-29和LoVo)中进行了体外分析,发现经具核梭杆菌上清液或琥珀酸处理的结直肠癌细胞系中IFN-β的表达降低。具核梭杆菌衍生的琥珀酸抑制IFN-β反应以促进结直肠癌的免疫治疗抵抗。
cGAS结合并激活IFN应答的刺激物cGAMP相互作用分子(STING),诱导IIFN,对免疫治疗的抗肿瘤免疫至关重要。作者假设具核梭杆菌诱导的肿瘤未能通过cGAS通路对免疫治疗产生应答,通过实时荧光定量PCR表明,在抗PD -1单抗存在的情况下,具核梭杆菌降低了CRC荷瘤小鼠肿瘤中的cGAS表达。在体外,实时荧光定量 PCR和Western Blot表明,具核梭杆菌上清液或琥珀酸处理后,cGAS表达下调。
Th1型趋化因子CCL5和CXCL10是两个关键的IFN应答蛋白,介导效应T细胞向肿瘤的转运。在经具核梭杆菌上清液或琥珀酸处理的CRC细胞中,CCL5和CXCL10的表达下调。此外,cGAS过表达消除了CRC细胞中琥珀酸或具核梭杆菌上清液诱导的IFN-β表达降低。迁移实验表明,琥珀酸和具核梭杆菌上清液减少了CD8+T细胞的迁移,而rCCL5和rCXCL10在体外阻断了CD8+T细胞的迁移。研究结果表明,具核梭杆菌衍生的琥珀酸破坏cGAS介导的IFN-β通路,减少肿瘤中Th1型趋化因子,从而抑制CD8+T细胞向肿瘤的体外迁移。
为了探讨cGAS在肿瘤细胞中过表达是否能增强抗肿瘤免疫并阻断具核梭杆菌代谢产物诱导的ICB-抑制作用。研究人员使用慢病毒在肿瘤细胞上过表达cGAS,发现cGAS的过表达可通过增强免疫反应、增加CD8+T细胞的浸润和提高细胞毒性作用,逆转具核梭杆菌代谢产物引起的肿瘤对免疫治疗的抵抗效应。据报道,肿瘤细胞内源性和宿主来源的cGAS-STING通路均有助于ICB的治疗。为了检测肿瘤细胞内或宿主来源的cGAS-STING通路是否参与了甲硝唑对抗PD-1单抗的重新敏感性,作者将对照细胞(MC38-Cgas+/+)和CRISPR-Cas9 cGAS-KO细胞 (MC38-Cgas-/-) 植入了野生型小鼠中,并观察到用甲硝唑根除具核梭杆菌使肿瘤对抗PD-1单抗重获敏感,而这种敏感性可通过清除肿瘤固有cGAS而消除。然后,将MC38细胞植入到野生型或cGAS缺陷小鼠中,宿主cGAS的耗竭并未改变甲硝唑的效果。这些数据表明具核梭杆菌衍生的琥珀酸诱导了IFN-β应答的丧失和对免疫治疗的抵抗,而甲硝唑通过依赖于肿瘤细胞衍生的cGAS通路使肿瘤对免疫治疗重新敏感。
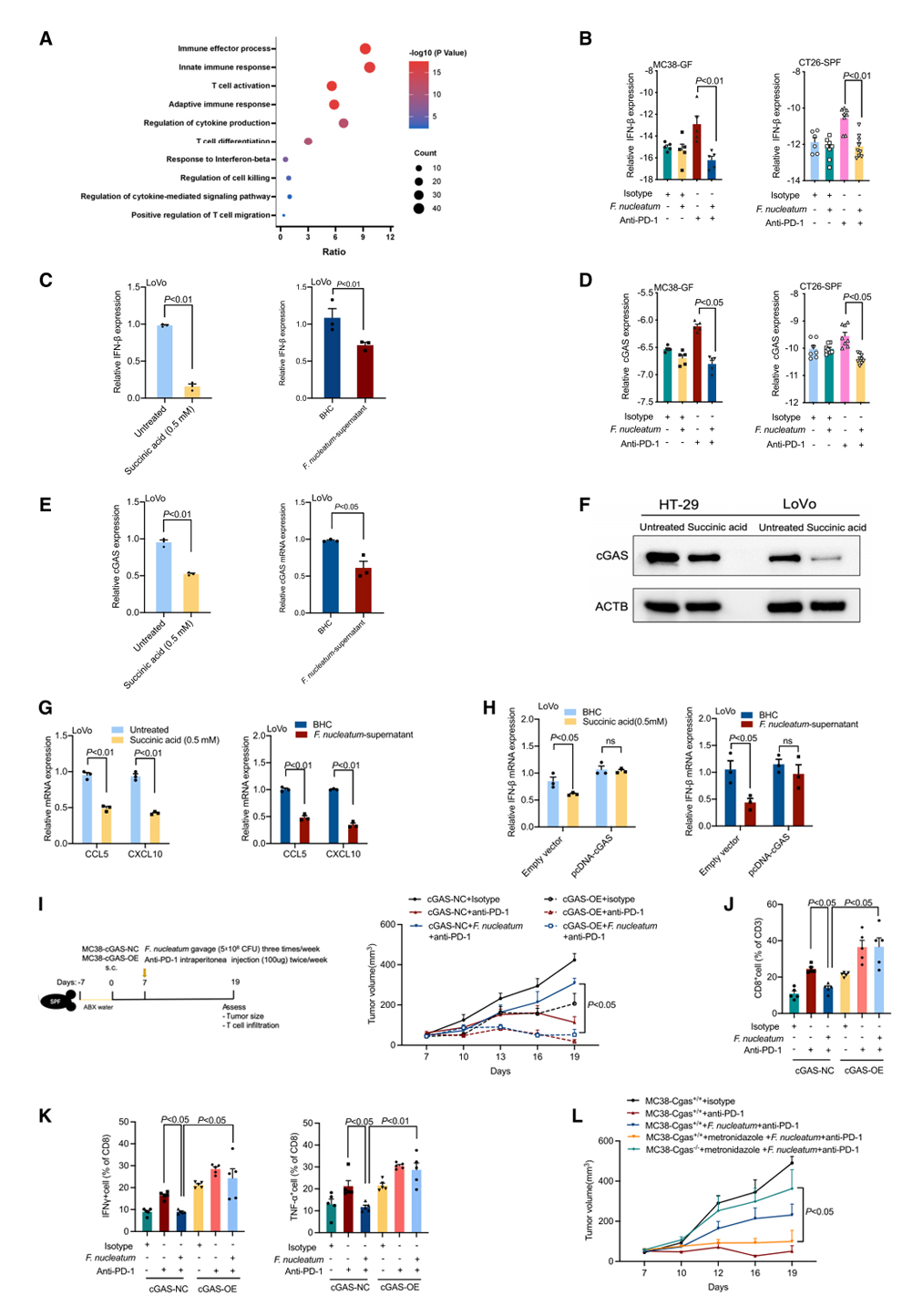
图5. 具核梭杆菌衍生的琥珀酸损害cGAS介导的IFN-β反应,减弱对免疫治疗的反应
具核梭杆菌衍生的琥珀酸激活SUCNR1-HIF-1α-EZH2轴减弱对免疫治疗的反应
为了确定具核梭杆菌代谢产物琥珀酸抑制cGAS表达的机制,作者进行了荧光素酶报告基因检测,观察到在经琥珀酸或具核梭杆菌上清液处理的CRC细胞中,cGAS启动子的转录活性受到抑制。随后使用加州大学圣克鲁兹分校(UCSC)基因组数据库预测了87个基因作为cGAS潜在的转录调控元件,分析了具核梭杆菌处理的CRC细胞的RNA-seq基因图谱,研究发现EZH2、MXI1, STAT3, ELF1,TBP,GTF2F1和E2F4这些基因在具核梭杆菌处理的细胞中显著上调。此外,实时荧光定量PCR显示,经具核梭杆菌上清液或琥珀酸处理后,EZH2表达上调。因此,EZH2可能是一个与cGAS启动子区结合的转录调控元件。为了检验这一假设,通过实时荧光定量PCR和蛋白质印迹法证明,沉默EZH2显著上调了cGAS的表达。染色质免疫沉淀实验表明,EZH2直接与cGAS的启动子区域结合,并且在琥珀酸或具核梭杆菌上清液处理的LoVo细胞中结合增强。
EZH2作为多梳抑制复合体2的主要成分,催化组蛋白H3第27位赖氨酸甲基化从而沉默其靶基因的表达。通过ChIP结果显示,琥珀酸或具核梭杆菌上清液处理LoVo细胞后,启动子区H3K27me3水平升高,确定了具核梭杆菌通过调控启动子区H3K27me3水平来抑制cGAS转录。随后,研究者使用两种体内模型来研究EZH2抑制剂(GSK126)治疗是否可以在体内阻断具核梭杆菌诱导的免疫治疗抵抗。结果发现GSK126阻断了具核梭杆菌诱导的抗PD-1单抗耐药。表明具核梭杆菌衍生的琥珀酸激活肿瘤细胞上的EZH2,从而导致肿瘤对免疫治疗的抵抗。
据报道,在癌症中,琥珀酸蓄积可稳定缺氧诱导因子1α(HIF-1α)并促进肿瘤进展。活性氧(ROS)的产生促进HIF-1α与EZH2启动子结合,导致EZH2表达升高。假设具核梭杆菌衍生的琥珀酸激活SUCNR1- HIF-1α-EZH2轴,从而抑制肿瘤对免疫治疗的反应。实验表明HIF-1α在经琥珀酸或具核梭杆菌上清液处理的CRC细胞中被激活。此外,Bay 87- 2243和2-MeOE2(HIF-1α的药物抑制剂)处理可抑制EZH2表达和启动子荧光素酶活性。同时,ChIP实验验证了HIF-1α直接结合于EZH2启动子区域。然后,研究者探讨HIF-1α抑制剂(Bay87-2243)是否可以在体内阻断具核梭杆菌诱导的免疫治疗抵抗。结果发现Bay 87-2243处理减弱了具核梭杆菌诱导的抗PD-1单抗耐药性。这些结果证实了具核梭杆菌的代谢产物琥珀酸激活了SUCNR1-HIF-1α-EZH2轴,从而导致CRC对免疫治疗无效。
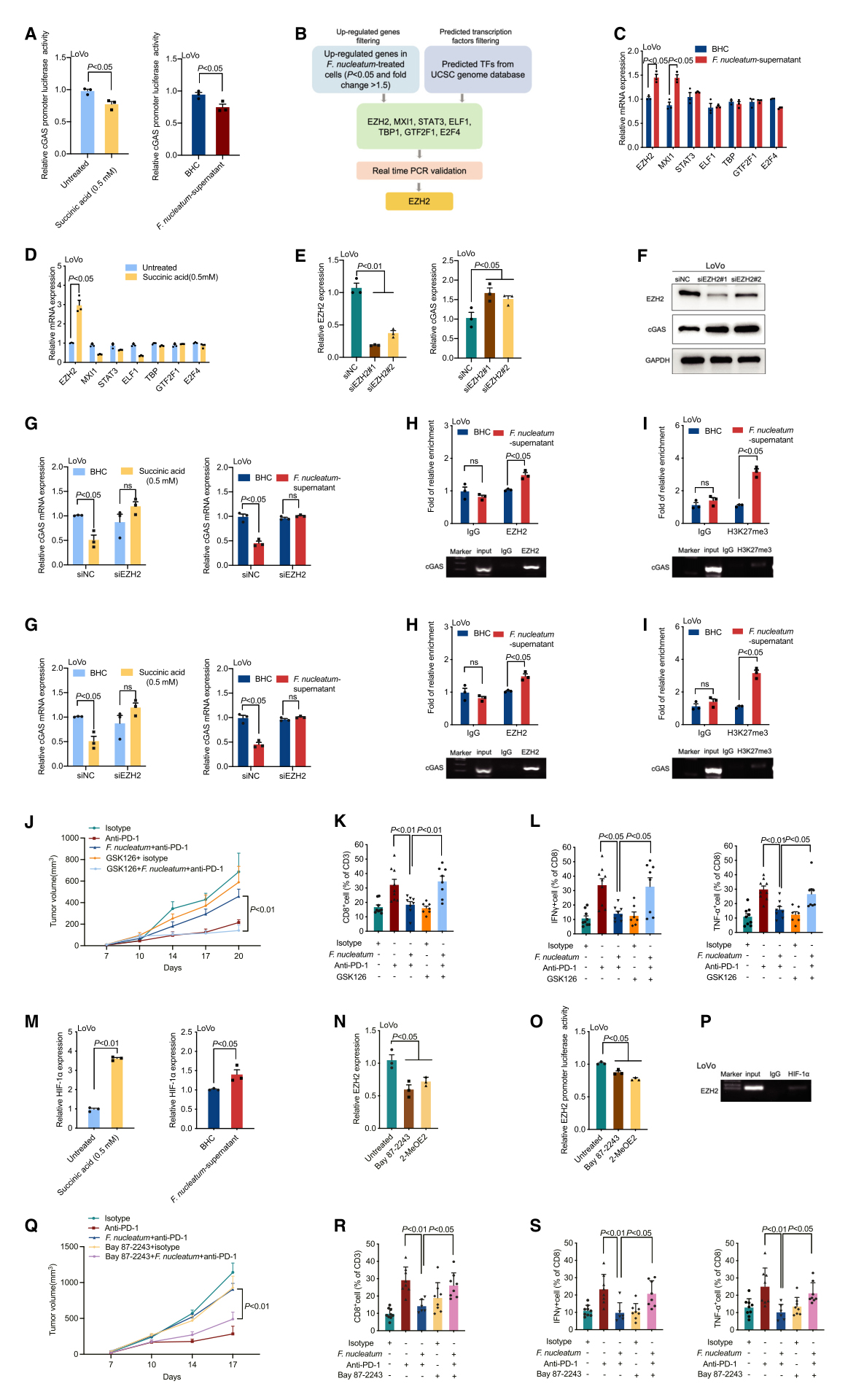
图6. 具核梭杆菌衍生的琥珀酸激活SUCNR1-HIF-1α-EZH2轴减弱对免疫治疗的反应
具核梭杆菌、EZH2和cGAS水平与结直肠癌患者的预后相关
为了探索EZH2,cGAS,IFN-β和Th1型趋化因子在预测结CRC患者PD-1阻断治疗反应中的作用,用免疫组化检测队列2中EZH2-cGAS- IFN-β轴的蛋白水平,检测发现,与有应答者相比,无应答者的肿瘤组织中检测到较高水平的EZH2,较低水平的cGAS、IFN-β以及Th1型趋化因子CCL5和CXCL10。在队列2中,具核梭杆菌的数量与cGAS、IFN-β、CCL5和CXCL10的表达水平以及CD8+T细胞密度呈负相关,与EZH2的表达呈正相关。最后,研究者评估了队列2中EZH2-cGAS- IFN-β与患者生存的相关性,观察到cGAS、IFN-β和Th1型趋化因子水平较高的患者PFS延长,EZH2水平较低的患者OS延长,而cGAS水平较高的患者OS较好。数据表明,F. nucleatum-EZH2-cGAS轴可能用作结直肠癌中PD-1阻断的潜在预后标志物。
具核梭杆菌产生的琥珀酸可激活琥珀酸受体SUCNR1-HIF-1α-EZH2轴,从而损害cGAS-IFN-β通路,并减少肿瘤中的Th1型趋化因子CCL5和CXCL10,从而限制CD8+T细胞运输到TME,从而降低CRC中PD-1阻断治疗的抗肿瘤应答。
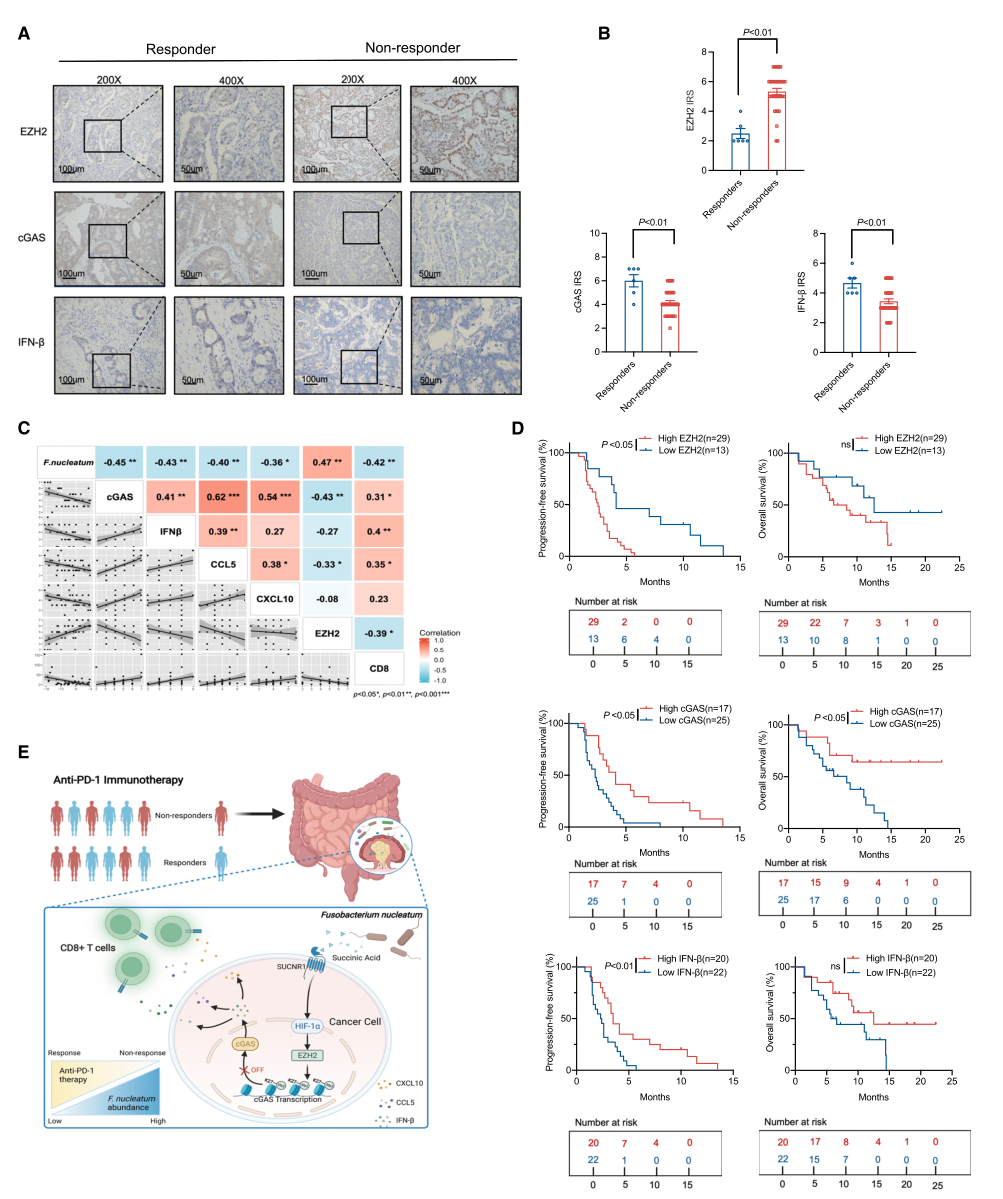
图7. 具核梭杆菌、EZH2和cGAS水平与结直肠癌患者的预后相关
结论
本研究对接受免疫治疗的结直肠癌患者的临床管理具有重要意义。粪便具核梭杆菌丰度和血清琥珀酸浓度与免疫治疗疗效密切相关,而且粪便具核梭杆菌和血清琥珀酸可能作为预测免疫治疗疗效的无创生物标志物。此外,根除肠道具核梭杆菌或降低琥珀酸含量可能是提高CRC免疫治疗临床应答的有效策略。
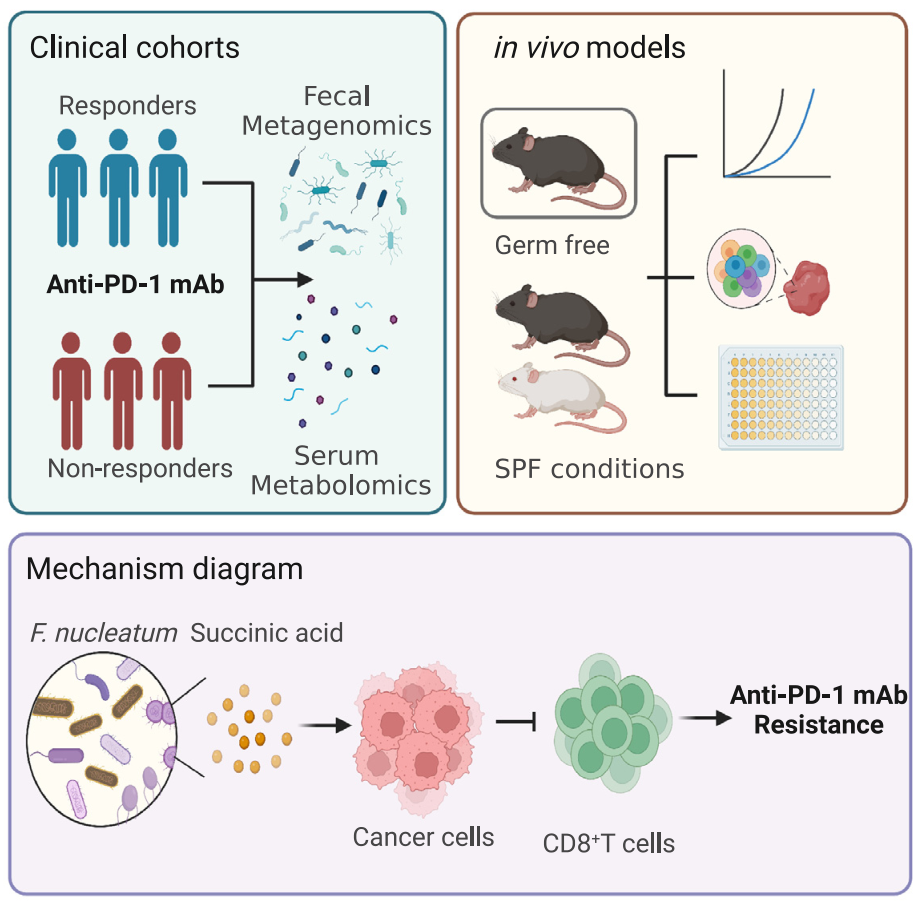
机理模式图
原文信息
Jiang SS, Xie YL, Xiao XY, et al. Fusobacterium nucleatum-derived succinic acid induces tumor resistance to immunotherapy in colorectal cancer. Cell Host & Microbe. 2023.
请扫描二维码阅读原文

绘谱帮你测
上述研究首次发现具核梭杆菌及代谢产物琥珀酸在结直肠癌免疫治疗中发挥耐药作用,为结直肠癌的肠道菌群-代谢-免疫交互对话提供新的见解。麦特绘谱为本研究提供Q300全定量代谢组学分析服务,发现了琥珀酸含量的变化,为后续机制研究提供关键线索。
截至2023年6月,Q300技术已协助客户发表70余篇SCI文章,平均IF>10,成果涵盖肿瘤/癌症、代谢性疾病、免疫疾病、神经系统性疾病、衰老、环境毒理学、中医中药等研究领域。
往期回顾
1. 客户案例 | Nature主刊:新机制!肠道菌群如何通过改变饮食成分来影响宿主免疫
2. 客户案例 | IF31 RCT试验:定植母亲阴道菌群对剖宫产婴儿神经发育和代谢组的影响
5. Cell Metabolism | 肠癌免疫治疗疗效差,氨积累惹的祸!
6. Nature | 菌群代谢物3-IAA有望大大提升胰腺癌化疗疗效!

